近日,重庆大学生命科学学院李正国教授和蔡江华教授课题组联合以色列魏兹曼科学研究所、美国斯坦福大学,在国际权威学术期刊Nature Communications 发表了最新的相关研究成果。该论文题目为《A NAC triad modulates plant immunity by negatively regulating N-hydroxy pipecolic acid biosynthesis》。

植物被视为小分子代谢物合成的天然工厂。据不完全统计,植物能够产生数百万中的小分子代谢物。这些代谢物在日常生活中扮演着重要的角色,它们不仅是人类营养、药物、食品、香料、化妆品等的来源,还是工业生产中的重要原料。此外,小分子代谢物也是植物与外界交流的“化学语言”,更是植物抵御外界胁迫的化学武器。小分子代谢物(Pipecolic acid, PA)是赖氨酸的衍生物,当人体感染疟疾或患有泽尔韦格综合症等疾病时,会大量积累。同样,植物在受病原菌侵染时,PA及其衍生物NHP的含量也会大量积累。研究表明,PA和NHP被认为是参与植物抗病应答的关键小分子代谢物,NHP的积累可以增强植物的抗病应答。然而,过量的NHP会引发细胞死亡、早衰及生长抑制等“副作用”。尽管我们对PA和NHP的生物合成途径已有深入了解,但无论在人体还是植物中,关于其转录调控机制的研究仍相对有限。
研究团队首先是利用合成生物学手段,构建了能够持续高产NHP的植株。这些植株不仅表现出更强的抗病性,同时也伴随着早衰。通过定量蛋白质组学技术鉴定出了受NHP显著诱导的NAC型转录因子NAC90。
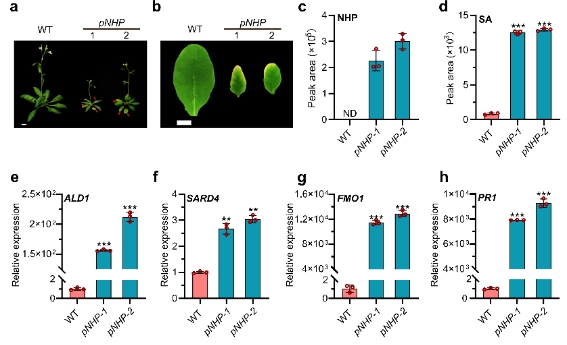
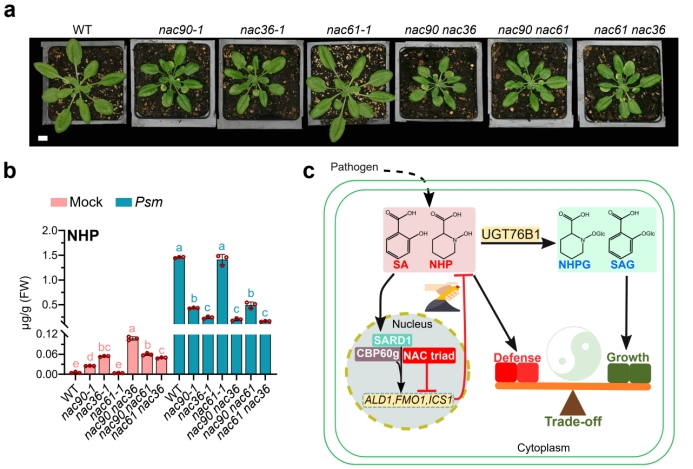
研究表明,NAC90是SARD1的靶基因,其表达受病原菌、水杨酸(SA)以及NHP的诱导。功能分析显示,NAC90敲除突变体会导致免疫持续激活、早衰、高水平的NHP和SA积累,以及NHP和SA生物合成酶基因的高表达。相反,NAC90过表达植株的抗病性显著下降,NHP和SA的积累减少,NHP和SA生物合成酶基因的表达也显著降低。进一步研究发现,NAC90能够直接抑制NHP和SA关键生物合成酶基因的表达,进而调控它们的生物合成。研究团队还发现,在NHP生物合成酶fmo1突变体的背景下,nac90介导的抗病性增强和早衰等表型被完全消除。这表明,NAC90对抗病应答的负调控作用完全通过NHP生物合成实现。更深入的研究揭示,NAC90能够与NAC家族中的其他两个成员NAC61和NAC36形成复合体,协同负调控NHP的生物合成和抗病应答。
这项研究扩展了目前对NHP的生物合成调控网络的理解,并提出了一个新的模型。该模型指出,除前期发现的NHP糖基化修饰(UGT76B1)之外,NAC转录因子在转录机制中扮演着“油门和刹车”的角色。当病原菌侵染植株时,NAC90和其他家族成员形成复合体,共同负调控NHP的生物合成,以维持植物生长和防御之间的平衡。该研究为NHP的转录调控提供了新的见解,为揭示植物抗病应答机制提供了新的思路,也为未来基于小分子代谢物调控农业抗病研究奠定了坚实基础。
原文链接:
https://www.nature.com/articles/s41467-024-51515-2