近年来,CRISPR/spCas9介导的基因编辑已经被广泛用于植物基因功能解析及农作物遗传改良应用研究。目前已经有多个经典的应用于植物的CRISPR/spCas9系统发表(Ma et al., 2016)。然而这些基因编辑系统仍存在开放性不足难以升级、多靶位点克隆复杂(尤其4个以上靶位点)、不适用于高通量操作等问题。
2019年1月,Horticulture Research 在线发表了重庆大学生命科学学院博士生胡楠为第一作者、李正国为通讯作者的题为“Rapid and user-friendly open-source CRISPR/Cas9 system for single- or multi-siteediting of tomato genome”的研究论文。该研究使用标准化生物砖组装技术设计开发了一种更加开放易升级的、更易用的并适用于高通量操作的植物CRISPR/Cas9系统(图1)。这一系统包括了pHNCas9(多靶位点适用)和pHNCas9HT(单一靶位点高通量构建适用)两个植物表达载体;多个保存有AtU3/AtU6/sgRNA元件的克隆载体。研究人员利用这一系统进行了试剂盒的研发并开发了相应的靶位点特异引物设计软件提高了系统的易用性。
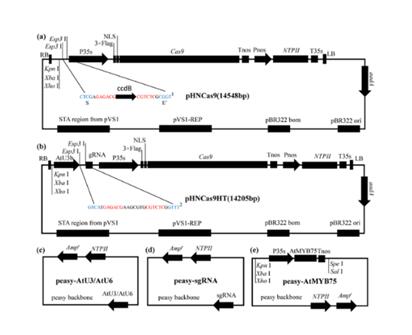
图1. CRISPR/Cas9系统示意图
在单一靶位点克隆方面该系统更加简便,易进行高通量构建操作。在多sgRNA表达盒克隆方面,研究人员改进了前人的克隆策略,成功的实现了8个sgRNA表达盒的一步克隆组装,降低了多靶位点操作的难度。研究人员在重要的肉质果实模式作物番茄中验证了这一系统单一靶位点、多靶位点及多基因编辑能力;分析了影响编辑的因素,在前人基础上进一步证实了sgRNA二级结构是影响靶位点编辑能力的最重要因素。通过对文中涉及的两个编辑效率偏低的靶位点对应的sgRNA二级结构分析判断:靶位点与sgRNA骨架存在连续6个以上碱基互补将在一定程度上影响sgRNA的编辑效率,而且这种稳定互补位置的不同可能对编辑效率存在更大影响,例如在SlGRAS8-sgRNA3(编辑效率:126/182)的二级结构中这种稳定互补影响到了repeat区域的形成(图2左),而在SlACS2&4-sgRNA1(编辑效率:0/9)中这种稳定互补则是影响了stem loop 1的形成(图2右)。这一结果也为高效的靶位点的选择提供了重要依据。
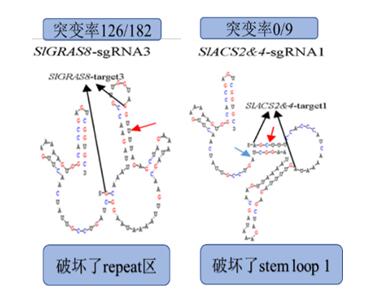
图2. 突变率较低的两个sgRNA特征
随着植物基因组数据急剧膨胀,但对这些植物基因进行功能解析的工作仍然进展缓慢。因此研发具有潜在高通量特性的CRISPR/Cas9系统对于高通量解析植物基因功能具有重要的潜在意义。然而在植物中进行CRISPR/Cas9系统的高通量应用仍然存在筛选阳性再生苗周期长、工作量大,后期筛选非转基因突变体困难等问题。为了解决这些技术难题,在本研究中创新性的提出了可视化CRISPR/Cas9系统的技术路线(在CRISPR/Cas9系统中添加能够促进花青素积累的生物砖结构)。使用可视化的CRISPR/Cas9系统进行的遗传转化能够在再分化30天内分化出浅紫色再生芽(图3),从而有效提高了基因编辑筛选效率。该研究得到了国家自然科学基金和科技部十三五重点研发计划项目的支持。
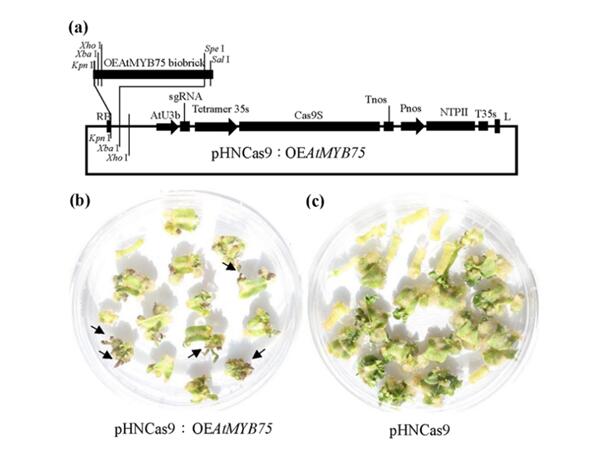
图3. 可视化生物砖在CRISPR/Cas9系统中的功能
原文链接:https://www.nature.com/articles/s41438-018-0082-6